Opdivo治疗中国肺癌患者结果公布
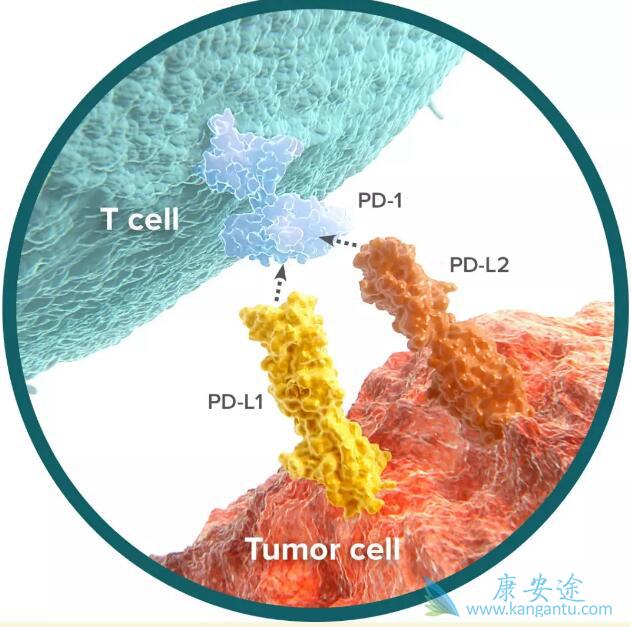
与标准化疗相比,Opdivo(nivolumab)可降低死亡风险 32%,提高客观有效率 4倍。
结果展示


4月16号下午,在AACR年会•临床试验口头汇报中,首席研究者、广东省肺癌研究所、广东省人民医院终身主任吴一龙教授公布了CheckMate-078的临床研究结果: PD-1抑制剂nivolumab首次在中国晚期非小细胞肺癌患者中获得成功!
目前,对于一线含铂化疗失败的肺癌患者,二线疗法推荐使用多西他赛(或联用其他药物)。CheckMate-078研究结果则显示出免疫治疗比多西他赛更优越的疗效:
1、总生存期:nivolumab相比多西他赛可以为既往接受过治疗的晚期NSCLC患者带来显著的生存获益(OS;HR 0.68;97.7% CI:0.52-0.90;p=0.0006),而且临床获益与PD-L1表达水平及肿瘤组织学类型无关。
2、疾病进展风险:与化疗相比,nivolumab可使疾病进展风险降低23%(HR 0.77;95% CI:0.62, 0.95;p=0.0147)。
3、客观缓解率(ORR):nivolumab组ORR:17%,多西他赛组:4%;nivolumab更胜。
4、中位持续缓解时间(mDOR):nivolumab组的中位应答持续期数据尚未成熟,多西他赛组为5.3个月。显然nivolumab组更能抑制肿瘤的发展。
5、不良相关事件:nivolumab组3-4级治疗相关不良事件(TRAEs)的发生率远低于多西他赛组(10%vs47%)。因3-4级TRAE停止用药的患者比例低于多西他赛组(3% vs 5%)。
数据来自BMS新闻通稿
https://news.bms.com/press-release/corporatefinancial-news/opdivo-nivolumab-first-pd-1-inhibitor-demonstrate-superior-sur
Opdivo(Nivolumab)全球第一只上市的PD-1药物,由百时美施贵宝公司开发,适应症包括黑色素瘤、转移性NSCLC、晚期肾癌、经典霍奇金淋巴瘤、头颈癌,肝癌以及结直肠癌、膀胱癌等
2014年7月4日在日本批准上市
2014年12月22日在美国批准上市
2015年6月19日在欧洲批准上市
在我国大陆,PD-1抑制剂必须在中国肿瘤患者身上重新进行临床试验才能通过上市审批。
2015年11月,BMS完成Opdivo在中国的注册,计划招募450位中国晚期肺癌患者,评价Opdivo对中国肺癌患者的治疗效果。
2017年12月1日,BMS宣布,经DMC认定CheckMate 078研究达到其主要终点,即与对照组(多西他赛)相比,在接受Nivolumab治疗的患者中观察到显著的OS获益,研究提前结束。
(责任编辑:康安途海外医疗)