默沙东3月16日宣布,FDA批准Keytruda(pembrolizumab)用于治疗成人及儿童难治性经典型霍奇金淋巴瘤(cHL),或之前接受过至少3种疗法的复发性cHL患者。成人患者使用每3周1次200mg的固定剂量,儿童剂量为2mg/kg(不超过200mg),直至疾病进展或出现不可耐受毒性,或在疾病未进展的情况下给药24个月。
FDA此次加速批准Keytruda新适应症是基于开放标签KEYNOTE-087研究的应答率和应答持续期数据。KEYNOTE-087研究纳入210例患者,在9.4个月的中位随访期内ORR达到69%,完全缓解率达到22%,部分缓解率为47%。在145例产生应答的患者中,中位应答持续时间为11.1个月。
在不良反应方面,5%的cHL患者中止治疗,26%的患者因为不良反应而间断性治疗,15%的患者需要接受系统性皮质类固醇治疗来处理药物相关的不良反应。
cHL是Keytruda继黑色素瘤、NSCLC、头颈癌之后获批的第4大适应症,也是其第1个血液肿瘤适应症。在适应症数量上,Keytruda与Opdivo的差距进一步缩小。
Opdivo与Keytruda适应症比较
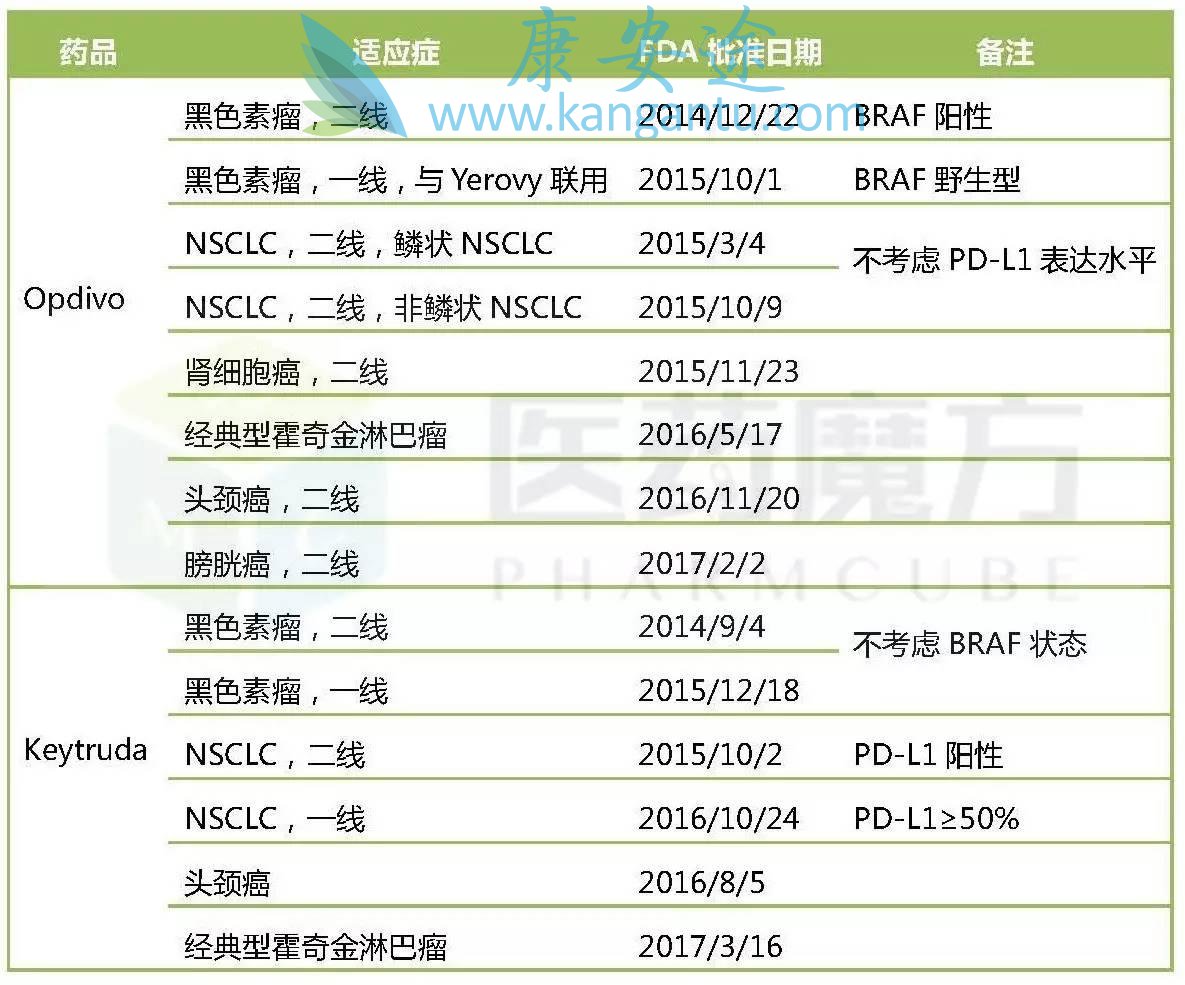
除了成功进军血液肿瘤领域外,Keytruda一线和二线治疗膀胱癌的sBLA也被FDA授予了优先审评资格,有望在6月14日之前获得批准,进一步缩小与Opdivo的差距。
O-K-T全球季度销售数据(亿美元)
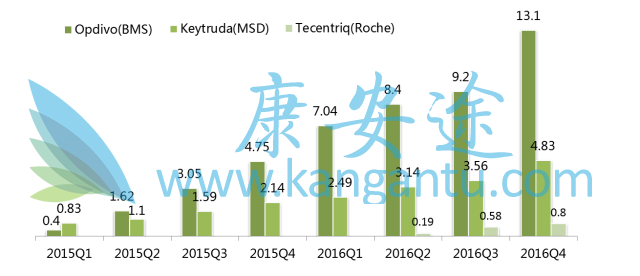
数据来源:可免费查询的医药魔方销售数据库
当然,cHL患者数量偏小,美国每年新确认患者8000例左右,更大的看点还在于肺癌、肝癌、结直肠癌等领域。各家PD-1/PD-L1抑制剂在肺癌适应症上的争夺已基本宣告结束,在其他适应症的开发速度上可谓各有千秋,各领风骚,具体进展我们将继续保持关注。










请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)