2002年全球第一个全人源单克隆抗体修美乐(Humira)获美国FDA批准上市。迄今为止,修美乐全球累计销售超过 1000 亿美元,是当之无愧的“药王”!。修美乐是继英夫利西单抗和依那西普之后,获得美国FDA批准的第三个TNF抑制剂类药物。修美乐最初由CambridgeAntibody Technologies(CAT)和BASF子公司BASF Knoll合作开发。2002年,雅培制药公司收购BASFKnoll而获得修美乐。
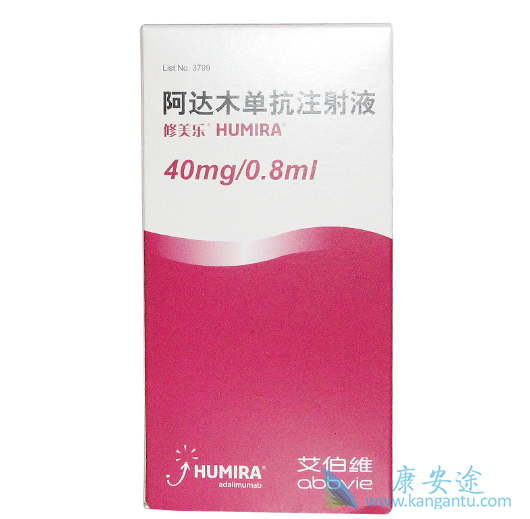
修美乐于2002年12月31日首次获FDA批准用于治疗中度至重度形式的风湿性关节炎,作为单一疗法或与MTX或其他改善疾病的抗风湿药物联合治疗,随后由Abbott公司以“Humira”商品名进行销售,该商品名代表了“human monoclonalantibody in rheumatoid arthritis”。尽管市场起步较晚,但修美乐已发展成为全球最畅销的抗体药物。与英夫利昔单抗(每4-8周静脉注射3-10 mg/kg)相比,修美乐每2周皮下给药40 mg/kg,停药风险更低,给药更简单(自动注射针)。

目前,修美乐在中国获批的适应症仅有3个,分别为类风湿性关节炎、强直性脊柱炎和斑块状银屑病。修美乐的治疗紧急不良反应包括结核病等潜伏感染的再激活,或更高几率的感染患病率,主要原因是由于TNF被抑制。根据Humira注射处方信息和药物指南,淋巴瘤的风险比普通人群高3倍,但与类风湿性关节炎患者相比,肿瘤风险与抗肿瘤坏死因子治疗无显著差异。修美乐适用于已对英夫利昔单抗不耐受的成人克罗恩病患者,而不适用于抗肿瘤坏死因子阻滞剂耐药的溃疡性结肠炎患者。
详情请访问 修美乐 https://www.kangantu.com/Exemptia/









请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)