血清生物标志物可以预测免疫治疗的反应吗?
免疫疗法,特别是一类称为免疫检查点抑制剂的免疫治疗剂近年来已经改变了几种类型的癌症治疗。到目前为止,美国食品和药物管理局已经批准了免疫检查点抑制剂来治疗各种癌症,包括黑色素瘤,霍奇金淋巴瘤和肺,肾,膀胱和头颈部的癌症。
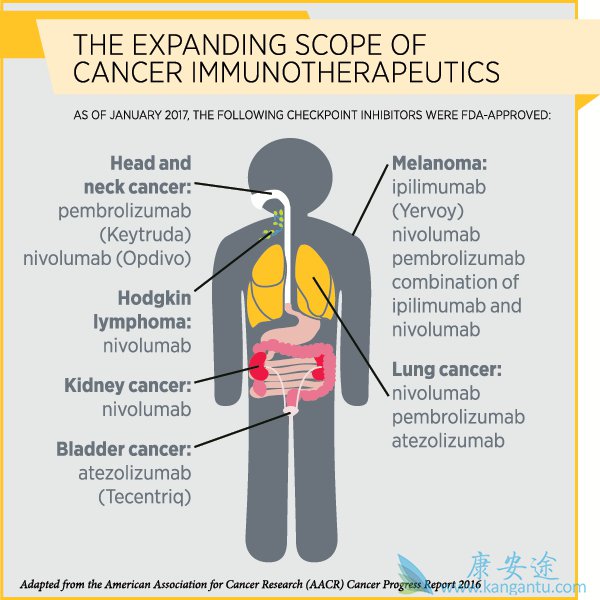
通过阻断某些蛋白质,免疫检查点抑制剂释放T细胞上的“制动”,以便它们可以攻击癌细胞。免疫检查点抑制剂ipilimumab(Yervoy)在检查点蛋白CTLA-4上释放制动剂,而诸如彭博罗珠单抗(Keytruda)和nivolumab(Opdivo)的治疗剂去除了检查点蛋白PD-1上的制动。
尽管免疫检查点抑制剂在一些患有多种癌症的患者中一直提供卓越,持久的反应,但只有约四分之一的这些癌症类型的患者对这些药物作出反应。因此,尝试增加对这些疗法作出反应的患者比例的下一步是了解谁回应以及为什么。已经努力确定有效的生物标志物的反应,但验证它们是一个挑战。
例如,研究人员正在研究蛋白质PD-L1是否可以作为靶向PD-1 / PD-L1途径的治疗药物如彭博罗珠单抗和奈韦单抗的生物标志物。PD-L1通常存在于肿瘤细胞或肿瘤微环境中的某些免疫细胞中,并结合PD-1(或应用制动器)在T细胞上并阻止其起作用。但是由于PD-L1的动态性质(意味着这种蛋白质的水平可能在疾病过程中发生变化),由于肿瘤的异质性(意味着肿瘤的不同区域可能具有不同的组成),导致组织采样错误,将这种蛋白质作为有效生物标记物的努力并没有非常成功。
血清生物标志物可能预测和影响反应
Dana-Farber 黑色素瘤肿瘤中心主任,Stephen Hodi医师,路德维希中心医学和研究员教授F. Stephen Hodi说,解决这个问题的一种方法是鉴定可以轻松测量和监测的血清生物标志物。在哈佛医学院在波士顿。

Hodi的研究小组发现,ANGPT2的血清水平预测晚期黑色素瘤患者免疫检查点抑制剂的反应和影响。他们还指出,ANGPT2可以作为免疫检查点和血管发生抑制剂联合治疗的靶标。Hodi及其同事在AACR的“ 癌症免疫学研究 ”杂志上发表了一篇论文,其中他们研究了血管生成素2(ANGPT2)在血管生成(血管形成)中的作用,在免疫调节中的作用及其作为免疫检查点生物标志物的潜力抑制剂。研究人员在文中写道:“血清学标记可能提供免疫激活的全面评估,并提供动态过程中的即时快照。
ANGPT2是血管成熟的调节剂,能够使血管生成。在先前的研究中,该蛋白质与抗贝伐单抗(Avastin)的抗性相关,贝伐单抗是靶向另一血管生成因子VEGF的抗体治疗剂。
在本研究中,由癌症研究所癌症研究所癌症免疫学梦想团队翻译研究基金会共同资助,研究人员研究了在三组治疗晚期黑色素瘤患者治疗开始前三个月内收集的血清样本抗CTLA4抗体ipilimumab,ipilimumab加贝伐珠单抗和抗PD1抗体nivolumab或pembrolizumab。患者来自三个不同的临床试验,其中有生存数据可用。
三项研究中约有17,20和37%的患者有完全或部分的反应,所有患者的中位随访时间为33个月。
研究人员发现,在这三项研究的患者中,高水平预处理血清ANGPT2水平的中位生存期显着高于治疗前水平较低的患者。
ANGPT2水平的变化与生存结果相关

为了了解血清ANGPT2水平的变化是否影响临床疗效,研究人员计算了治疗前和治疗期间蛋白质水平的倍数变化,发现预处理ANGPT2水平高但倍数变化大的患者存活率最差,其中具有低预处理蛋白水平,但小倍数变化具有最佳的存活率。具有高预处理ANGPT2水平和小倍数变化的患者和具有低预处理ANGPT2水平和大倍数变化的患者具有中等存活。
动态血清ANGPT2水平与存活之间的相关性巩固了该蛋白作为预后生物标志物的作用。
ANGPT2行动背后的机制
研究人员继续研究ANGPT2影响临床疗效的机制,并在实验室实验中发现,ANGPT2可增强特异性巨噬细胞亚群中PD-L1的表达,促进免疫抑制,促进肿瘤和转移。
“这些体外研究表明血管生成因子不仅在肿瘤血管形成中发挥作用,而且具有免疫调节作用; 因此,抑制血管发生的治疗剂可以与免疫检查点封锁协同作用,“Hodi说。
研究人员正在进行第1阶段试验,检测晚期黑色素瘤患者中tremelimumab(一种研究性CTLA-4靶向免疫检查点抑制剂)和ANGPT2抗体的组合。














请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)