临床意义
癌症
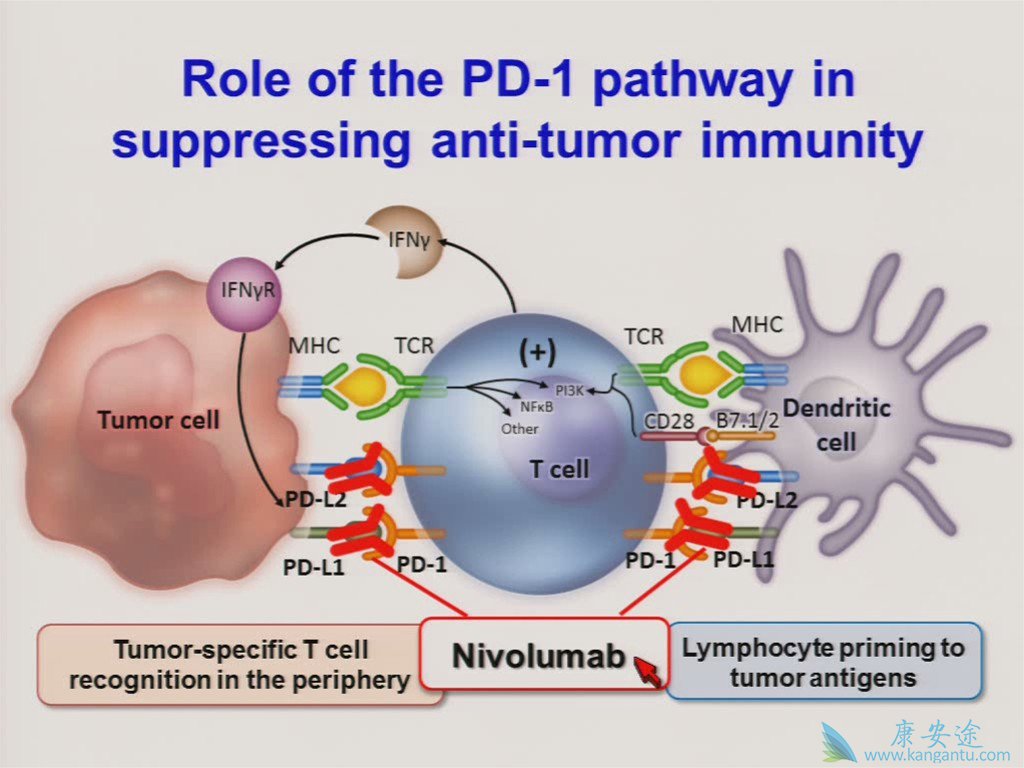
PD-L1是PD1的配体,在几种癌症中高度表达,因此PD1在癌症免疫逃逸中的作用已经很成熟。[24] [25] 的单克隆抗体靶向PD-1,可以增强免疫系统被用于治疗开发癌症。[26]许多肿瘤细胞表达PD-L1,免疫PD-1配体; 抑制PD-1和PD-L1之间的相互作用可以增强T细胞体外的反应,并调节临床前抗肿瘤活性。这被称为免疫检查点封锁。
使用抗PD1和抗CTLA4治疗剂的联合治疗已经成为检查点抑制领域的重要肿瘤治疗方法。
在治疗各种癌症中,PD1和CTLA4抗体的组合已被证明比单独的任一抗体更有效。两种抗体的作用似乎并不多余。抗CTLA4处理导致增强的抗原特异性T细胞依赖的免疫反应,同时抗PD-1似乎激活CD8 + T细胞以裂解癌细胞的能力。
在临床试验中,尽管由于抗CTLA4治疗引起的毒性水平升高,但联合治疗已被证明可有效减少对单一共同抑制性阻断无反应的患者的肿瘤大小。诱导高达十倍的更高数目的CD8 + T细胞正在积极浸润肿瘤组织的PD1和CTLA4的组合。作者推测,更高水平的CD8 + T细胞浸润的是由于抗CTLA-4抑制CD4 + T细胞与T调节细胞的转化率和进一步降低T调节抑制与抗PD-1。这种组合促进了对肿瘤的更强烈的炎症反应,其减少了癌症的大小。最近,
使肿瘤接受抗PD1治疗所必需的分子因子和受体依然未知。PDL1在癌细胞表面的表达起着重要作用。PDL1阳性肿瘤是组合治疗反应的两倍。然而,PDL1阴性肿瘤患者对抗PD1的反应也有限,表明PDL1表达不是治疗有效性的绝对决定因素。
肿瘤中较高的突变负荷与抗PD-1治疗的更大作用相关。在临床试验中,受益于抗PD1治疗的患者具有癌症,例如黑素瘤,膀胱癌和胃癌,其平均突变中位数高于没有对治疗无反应的患者的中位数。然而,较高的肿瘤负荷与PD-1免疫阻断的临床效果之间的相关性仍然不确定。
一种这样的抗PD-1抗体药物,nivolumab,(Opdivo - Bristol Myers Squibb的),产生了在非小细胞肺癌,黑素瘤和肾细胞癌完全或部分响应,在临床试验中,总的296例。结肠癌和胰腺癌没有反应。
也是靶向PD-1受体的Nivolumab(Opdivo,Bristol-Myers Squibb)于2014年7月在日本被批准,并被美国FDA在2014年12月批准用于治疗转移性黑素瘤。
FDA还批准了2014年9月批准用于治疗转移性黑色素瘤的Pembrolizumab(Keytruda,MK-3475,Merck)。彭博罗珠单抗已经在英国通过英国早期药物治疗计划(EAMS)于2015年3月通过英国的晚期黑色素瘤患者进入。它被用于美国肺癌,淋巴瘤和间皮瘤的临床试验。测量成功,副作用很小,取决于药物的制造商向FDA提交申请,以批准用于这些疾病。2015年10月2日,彭博拉珠单抗经FDA批准用于其他治疗后疾病进展的晚期(转移)非小细胞肺癌(NSCLC)患者。
靶向PD-1受体(检查点抑制剂)的早期发展中的其他药物是Pidilizumab(CT-011,Cure Tech)和BMS-936559(Bristol Myers Squibb)。既Atezolizumab(MPDL3280A,Roche)和Avelumab(默克公司,德国达姆施塔特&辉瑞)靶向类似PD-L1受体。
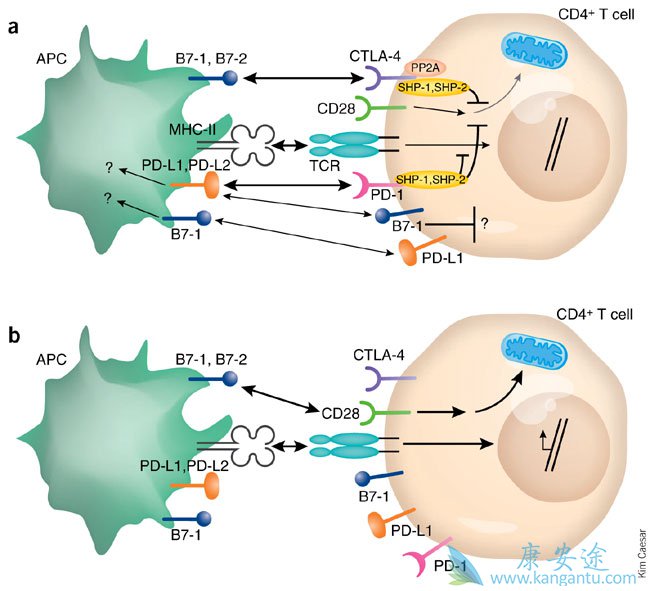
动物研究
HIV
靶向PD-1与其他负免疫检查点受体(如TIGIT)组合的药物可能会增加免疫反应和/或促进HIV消除。T淋巴细胞表现出慢性HIV感染的情况下,PD-1的升高的表达。加高的PD-1受体的存在对应于HIV特异性CD8 +细胞毒性和CD4 +辅助性T细胞群是在打击病毒重要的疲惫。PD-1的免疫阻断导致T细胞炎症表型的恢复,以抵抗疾病的进展。
阿尔茨海默病
PD-1的阻断导致脑淀粉样蛋白-β斑块减少,并改善小鼠的认知功能。[39] PD-1的免疫诱发封锁该招募单核细胞源性巨噬细胞到然后能够从组织清除淀粉样蛋白β斑块的脑的IFN-γ依赖性免疫应答。发现与抗PD-1重复给药是维持治疗效果所必需的。淀粉样蛋白原纤维是免疫抑制的,并且通过检查原纤维在神经炎症疾病中的作用已经分别证实了这一发现。PD-1通过增强免疫活性和引发允许脑修复的免疫途径抵消原纤维的作用的影响。














请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)