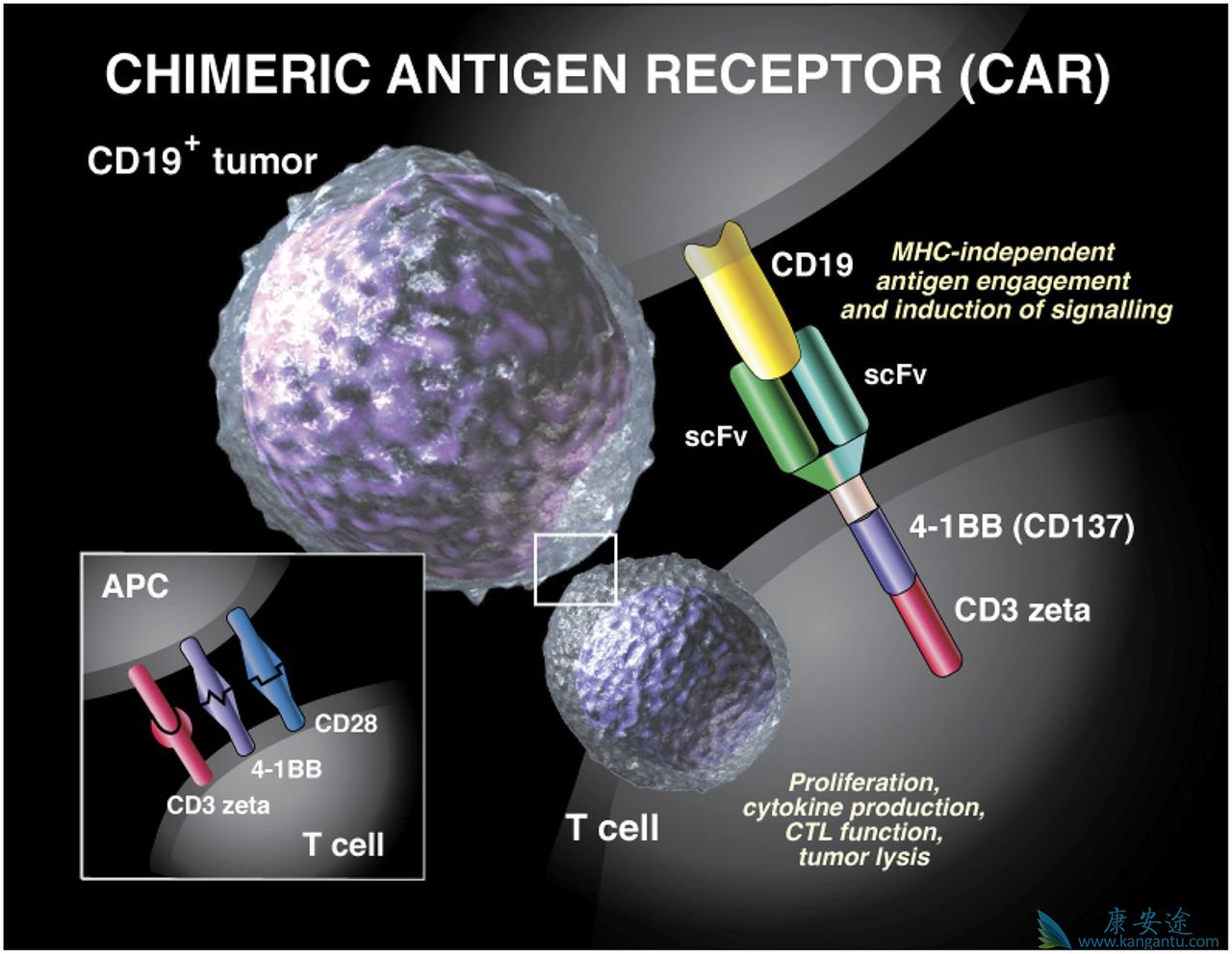
10月31日,瑞士诺华制药称,公司已经向美国FDA提交了CAR-T疗法Kymriah(tisagenlecleucel)用于不适于接受自体干细胞移植的复发性或难治性大B细胞淋巴瘤(DLBCL)成人患者治疗的补充新药申请(sBLA)。
今年4月,该药物用于复发/难治DLBCL已经获得FDA突破性疗法认定,该适应症获批后将是Kymriah的第二个获得批准的适应症。2017年8月30日,比预定的PDUFA日期提前5周,FDA宣布批准诺华CAR-T细胞疗法正式上市,用于治疗复发性或难治性儿童、青少年B-细胞急性淋巴细胞白血病(ALL),成为全球首款上市的嵌合抗原受体T细胞疗法。Kymriah作为新型细胞免疫疗法,通过利用患者自身T细胞经过一次性治疗来对抗所患的癌症。
诺华首席医疗官及全球药物开发负责人Vas Narasimhan表示:“Kymriah的批准代表了个体化免疫治疗发展的历史突破性时刻,我们将会致力于将此药物用于更多可以从中获益的患者群体。用于DLBCL患者治疗JULIET研究的缓解率数据已经证实Kymriah有潜力成为这些患者新的治疗选择,我们非常期待与FDA合作以尽快推进Kymriah第二个适应症的批准。”
是非霍奇金淋巴瘤(NHL)的最常见类型,在全球范围内约占所有NHL患者的40%。大约会有50%-60%的患者在接受一线治疗后会获得并维持疾病完全缓解,但同时大约会有近1/3的患者在一线治疗后出现疾病复发,只有25%的复发/难治性患者是适合接受自体干细胞移植的,这也是这些患者主要依靠的二线疗法。复发/难治患者不接受继续治疗将只有3-4个月的生存期。

 添加康安顾问,想问就问
添加康安顾问,想问就问

请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)