卡马替尼(商品名为Tabrecta®)于2020年5月6日获得美国FDA批准上市,获批治疗的疾病是MET外显子14跳跃突变的转移性非小细胞肺癌(NSCLC)。同时,FDA批准了检测该类基因突变的产品,商品名为FoundationOne®CDx。Capmatinib曾获得FDA授予的突破性疗法称号。2020年2月11日,诺华宣布FDA接受了卡马替尼的新药申请并给予了优先审查。卡马替尼(Tabrecta®)是第一个FDA批准的MET外显子14跳跃突变转移性非小细胞肺癌特异性靶向疗法。
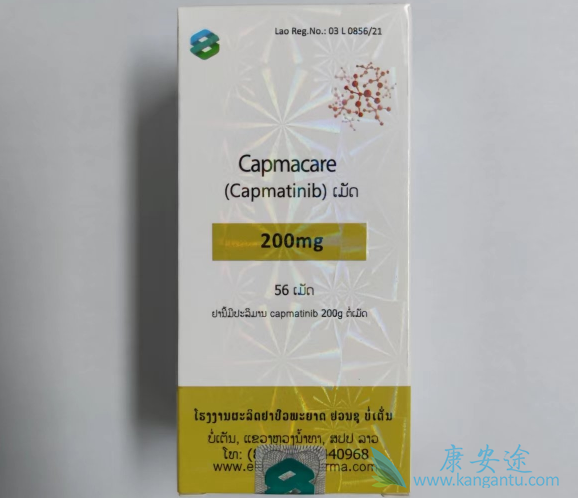
卡马替尼(Tabrecta®)是一种口服的高选择性小分子MET抑制剂,可以抑制由肝细胞生长因子结合或MET扩增引起的MET磷酸化,以及MET介导的下游信号蛋白的磷酸化以及MET依赖的癌细胞的增殖和存活。
卡马替尼最初由Incyte Corporation研发,2009年11月,诺华与Incyte签订了全球独家开发卡马替尼许可协议,该协议还涵盖了芦可替尼的除美国外地区的商业化权,Incyte保留了在美国共同推广Capmatinib的权利并参与该化合物在全球的发展。2014年10月,诺华公司和施贵宝签订临床I/II期试验合作,以评估诺华的三个分子靶向化合物(色瑞替尼,卡马替尼和纳扎替尼)结合BMS的Nivolumab在患有非小细胞肺癌的安全性、耐受性和初步功效。2015年1月,诺华公司启动了一项临床II期试验,旨在研究卡马替尼联合Binimetinib,Alpelisib和色瑞替尼治疗晚期非小细胞肺癌患者的抗肿瘤活性。
数据显示,卡马替尼(Tabrecta®)目前处于治疗胶质母细胞瘤、肝癌、恶性黑色素瘤的临床II期研究,治疗结直肠癌、头颈癌的临床I/II期研究,治疗实体瘤的临床I期试验阶段。卡马替尼用于治疗肾细胞癌的临床研究目前无进展。
卡马替尼(Tabrecta®)的批准基于GEOMETRYmono-1的研究结果。结果显示,疗效显著,未接受过治疗的患者组(n = 28)和先前接受过治疗的患者组(n = 69)的ORR分别为68%和41%,中位缓解持续时间分别是12.6个月和9.7个月。卡马替尼(Tabrecta®)的批准为具有这种突变的NSCLC患者提供了新的希望。更多卡马替尼信息可添加下方康安顾问微信咨询: