8 月 2 日,美国 FDA 批准了公司 Epclusa® (sofosbuvir 400mg/velpatasvir 100mg) 的说明书扩展更新申请,使该药物成为了第一个全口服、治疗泛基因型慢性丙肝病毒和 HIV 病毒共感染的成人患者的单一片剂疗法。丹佛健康医疗中心感染疾病科负责人 David Wyles 博士表示:“ Epclusa 的扩展使用批准,使具有较大治疗需求的 HCV 全基因型共感染患者可以得到这一单片药物的治疗。同时,临床医生对于 HCV/HIV 共感染的治疗也将多出一个重要的新的治疗选择。 ”
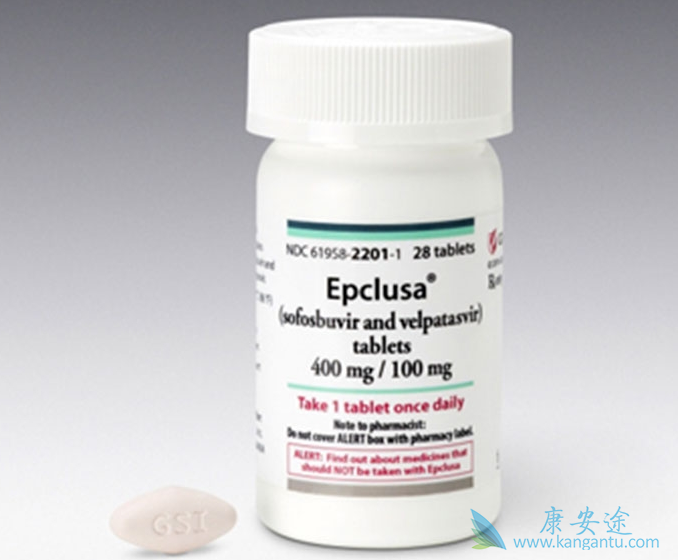
这次补充新药申请(sNDA)是基于一项开标的临床 3 期研究 ASTRAL- 5 的试验数据,该研究共入组 106 例患者,评估了 1 - 4 基因型 HCV/HIV 共感染患者接受 12 周 Epclusa,同时可施用抗逆转录病毒药物治疗的疗效。这项研究,95%(101/106) 的治疗患者达到了主要研究终点 SVR12,该指标意味着治疗后 12 周检测不到病毒载量。
吉利德科学公司总裁、首席执行官 John F. Milligan 博士表示:“吉三代Epclusa 已经简化了 HCV 单独感染患者的治疗程序,我们非常高兴 HCV/HIV 共感染的患者也能得到这针对泛基因型的单一片剂的有效治疗。这次新的批准也践行了我们对 HCV 及 HIV 治疗界所作出的为患者带来可以进一步满足治疗需求的创新药物的承诺。”
详情请访问 吉三代 https://www.kangantu.com








请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)