在2017年的7月18日,FDA批准了Gilead公司的新一代丙肝治疗药物Vosevi上市,Vosevi(sofosbuvir 400 mg / velpatasvir 100mg / voxilaprevir 100mg)用于治疗伴有轻度肝硬化机无肝硬化的基因1~6型丙肝病毒感染成人患者。适用患者群体为先前用含有NS5A抑制剂方案治疗失败的基因型1-6的成年患者,以及先前使用含有sofsbuvir但无NS5A抑制剂方案失败的基因型1a或3的成年患者。
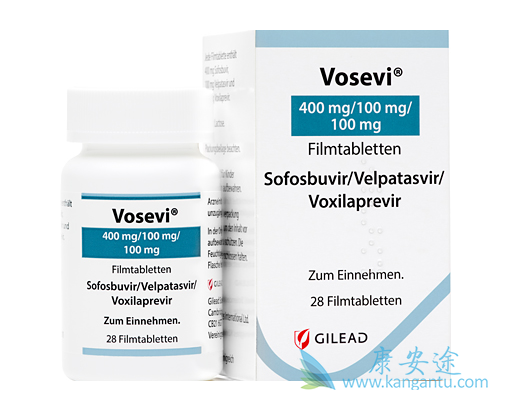
这也是FDA批准的第二个全基因型丙肝新药,2016年6月28日,FDA就曾批准了吉利德(Gilead)的丙肝药Epclusa?(索非布韦/维帕他韦复合片Sofosbuvir/velpatasvir,国内称为“吉三代”)上市,用于治疗成人所有基因型的慢性丙型肝炎病毒(HCV)感染,包括伴有代偿性和失代偿性肝硬化患者群体。
研究人员通过两个3期临床试验(POLARIS-1和POLARIS-4)评估了吉四代的安全性与有效性,试验涉及约750名患者参与,其中包括没有肝硬化症状或轻度肝硬化的成年病人。与安慰剂相比较,第一项试验评估12周疗程的Vosevi治疗HCV基因型1感染成年患者,他们先前接受NS5A抑制剂药物治疗失败。HCV基因型2、3、4、5或6的患者也都接受了Vosevi。
详情请访问 吉四代 https://jsid.kangantu.com








请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)