2017年8月17日,MISSISSAUGA ON / CNW / - 加拿大吉利德科技公司(Gilead Canada)今天宣布,加拿大卫生部颁发了VOSEVI™遵守声明(sofosbuvir 400 mg / velpatasvir 100mg /维生素100 mg)片剂,一种泛基因型单片剂方案,用于治疗以前用含有NS5A抑制剂的方案或基因型治疗的基因型1,2,3,4,5或6的成年人的慢性丙型肝炎病毒(HCV)感染1,2,3或4,先前用含有sofosbuvir的方案治疗,不含NS5A抑制剂。批准是基于第3阶段POLARIS-1和POLARIS-4研究的数据,其评估了12周的VOSEVI在直接作用的抗病毒经历的慢性HCV感染患者,没有肝硬化或补偿性肝硬化。
“HCV治疗已经通过有效的直接作用的抗病毒治疗方案转变,从而使医护人员有机会治愈许多患者。然而,对于那些在先前治疗失败的患者来说,仍然没有足够的临床需要获得有效和良好的耐受性选择,“艾伯塔省大学传染病科医学教授Stephen Shafran博士说。“VOSEVI第3期临床研究已经导致治愈率高于以前未被治愈的几种广泛规定的DAA方案,为医生提供了一个重要的新治疗方案,可以为最难治愈的患者提供希望。”
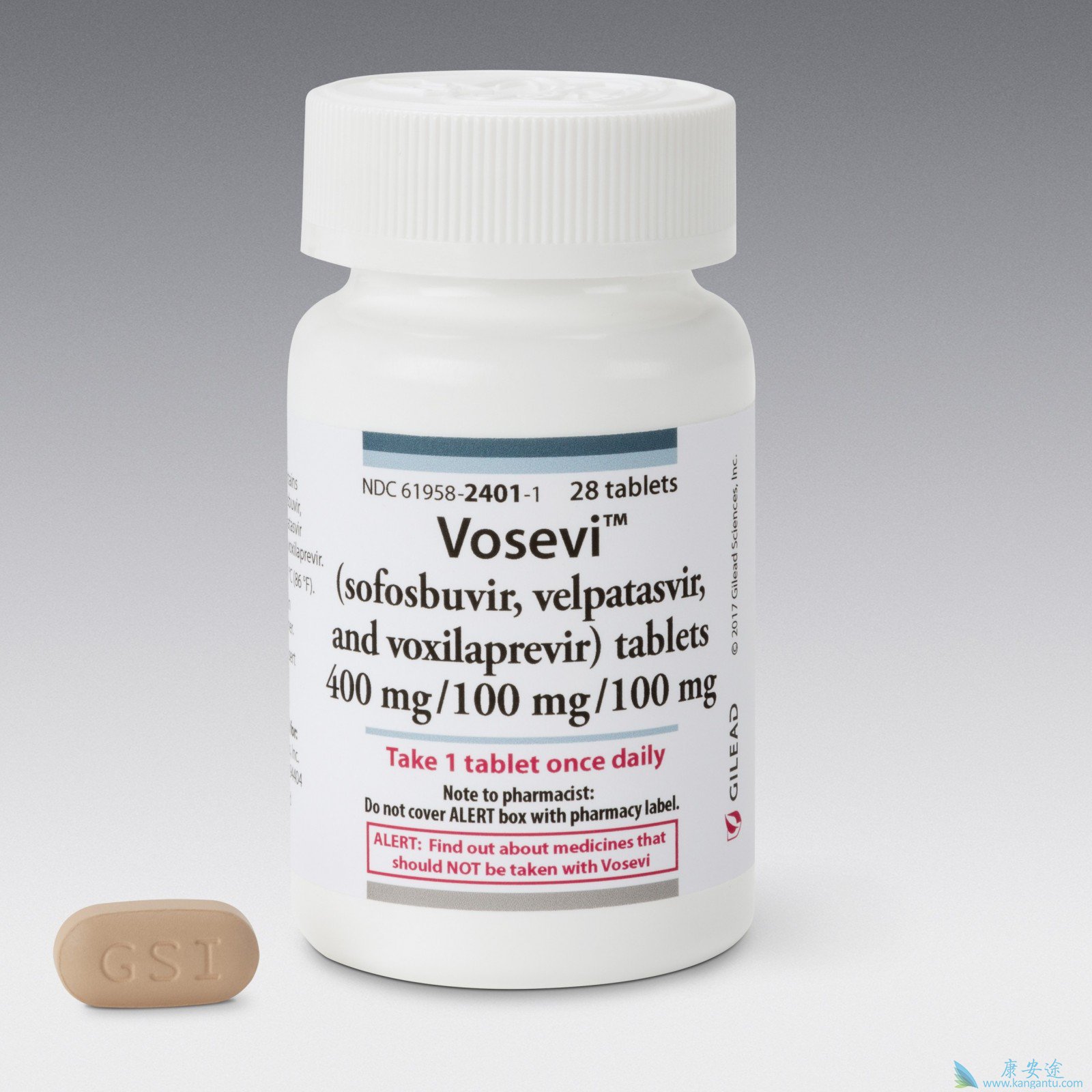
VOSEVI是Gilead基于sofosbuvir的DAA治疗产品组合中最新的单一平板药物,为HCV患者提供了短期治疗方法,以治愈HCV感染,方便与每日一次的单片剂方案相关联。自2013年以来,吉利德已经推出了四种HCV治疗方案,其中包括三种单片剂治疗方案。迄今为止,世界范围内估计有150万患者已被规定为基于sofbububir的方案。
Gilead加拿大总经理Kennet Brysting表示:“Gilead的HCV单片剂方案组合的发展是由于我们致力于解决以前未满足的需求,并为尽可能多的HCV患者人群提供治愈的可能性。 。“加拿大VOSEVI的批准完成了我们的HCV产品组合,这将使公司能够承诺合作伙伴关系,这将有助于推动到2030年前在加拿大消除HCV的进展。”
VOSEVI的批准得到POLARIS-1研究的第3阶段数据的支持,该研究评估了HCV基因型1,2,3,4,5或6感染的成年人12周的治疗,其中有或没有补偿性肝硬化患者,先前治疗失败含有NS5A抑制剂的方案,以及来自POLARIS-4研究的第3期数据,评估在具有或不具有补偿性肝硬化的HCV基因型1,2,3或4感染的成年人中的治疗12周的治疗,其在DAA-不含NS5A抑制剂的方案。在这两个研究中的这些人群中,445名患有VOSEVI(97%)的患者中有431名达到SVR12的主要终点,定义为在完成治疗后12周维持不可检测的病毒载量。
患有VOSEVI的患者最常见的不良事件(≥10%)为头痛,疲劳,腹泻和恶心。由于不良事件而永久停止治疗的受试者的比例为接受VOSEVI治疗12周的受试者的比例为0.2%。
“随着加拿大向世界卫生组织致力于到2030年消除丙型肝炎,所有患者都有机会获得治愈,无论他们是新来的治疗方法,还是以前的治疗都失败了,”多伦多总医院加拿大肝病基金会和肝病学家主席莫里斯谢尔曼博士说。“治疗应该是每个人的选择,包括那些仍在寻求治愈的人。CLF高兴地看到可以使用其他有效的治疗方法,并且无论身在何处,或者他们的支付能力,所有患者都可以使用它们。“








请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)