3月20日,诺和诺德宣布向FDA提交了口服索马鲁肽的两项新药上市申请(NDA)。其中一项是寻求FDA批准口服索马鲁肽辅助饮食和运动用于改善2型糖尿病患者的血糖控制。诺和诺德为此项申请还使用了优先审评券,使得该申请的审批周期缩短至6个月。

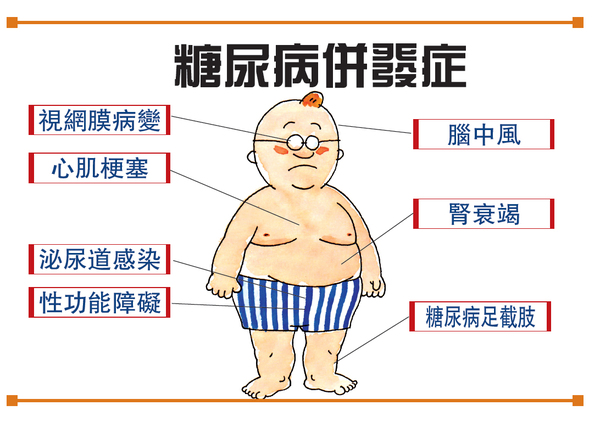
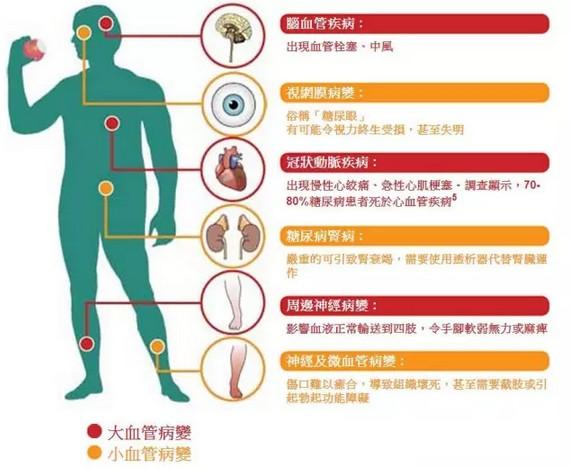
另外一项则是寻求FDA批准口服索马鲁肽用于降低确定伴有心血管疾病的成人2型糖尿病患者的主要心血管事件(包括心脏病发作、卒中和死亡)风险。该申请走标准审评程序,审批周期为10个月。
此外,诺和诺德同时也向FDA提交了Ozempic(索马鲁肽)每周1次注射0.5mg或1mg的补充申请(sNDA),用于降低伴有心血管疾病的成人2型糖尿病患者的主要心血管事件(包括心脏病发作、卒中和死亡)风险。该申请同样是走标准审评程序,审评周期为10个月。