吉利德承诺新型肝炎药物的通用版本
在吉列德科学获得FDA批准用于慢性乙型肝炎病毒(HBV)的新药之后,该公司表示即将推出低成本的通用版本。这对Gilead来说是一个好消息,Gilead已成为国会代表针对其Sovaldi和Harvoni丙型肝炎治疗费用高的对象。
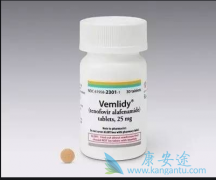
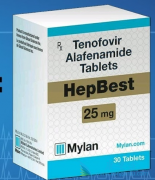
FDA最近批准了替诺福韦甲酰胺,TAF(Vemlidy)25 mg,每日一次治疗慢性乙型肝炎病毒(HBV)感染补偿性肝病的成人。此外,欧洲药品管理局(EMA)科学委员会的人类使用药物委员会(CHMP)对该公司的Vemlidy营销授权申请(MAA)采取了积极的看法。CHMP的建议现在将由欧盟委员会进行审查,欧盟委员会有权批准在欧盟,挪威和冰岛的28个国家使用的药物。
在吉列德科学获得FDA批准用于慢性乙型肝炎病毒(HBV)的新药之后,该公司表示即将推出低成本的通用版本。这对Gilead来说是一个好消息,Gilead已成为国会代表针对其Sovaldi和Harvoni丙型肝炎治疗费用高的对象。
FDA最近批准了替诺福韦甲酰胺,TAF(Vemlidy)25 mg,每日一次治疗慢性乙型肝炎病毒(HBV)感染补偿性肝病的成人。此外,欧洲药品管理局(EMA)科学委员会的人类使用药物委员会(CHMP)对该公司的Vemlidy营销授权申请(MAA)采取了积极的看法。CHMP的建议现在将由欧盟委员会进行审查,欧盟委员会有权批准在欧盟,挪威和冰岛的28个国家使用的药物。
Vemlidy的批准得到了2个国际3期研究的48周资料的支持,其中包括1,298例治疗无效和经治疗的成人慢性HBV感染患者。研究108随机和治疗425例HBeAg阴性的Vemlidy或Viread患者,研究110随机和治疗873例HBeAg阳性的Vemlidy或Viread患者。
根据慢性乙型肝炎患者在48周治疗期间血浆HBV DNA水平低于29 IU / mL的患者的百分比,两项研究均符合Viread的非劣效性的主要终点。
在两项研究的综合分析中,与使用Viread治疗的患者相比,接受Vemlidy的患者表现出某些骨和肾实验室参数的改善。Vemlidy组患者的血清丙氨酸氨基转移酶(ALT)水平正常化的数值也较高。
Vemlidy和Viread在两项研究和停药中均有良好的耐受性,因为不良事件分别为1%和1.2%。在两项研究中最常报道的不良事件包括头痛,腹痛,疲劳,咳嗽,恶心和背痛,并且在接受Vemlidy或Viread的患者中以相似的速率发生。
报道了使用核苷类似物的乳酸性酸中毒和伴有脂肪变性的严重肝肿大,包括致命的病例。结果,Vemlidy携带盒装警告:乳酸性酸中毒/重度肝肿大伴有脂肪变性和后期治疗严重急性加重乙型肝炎。









请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)