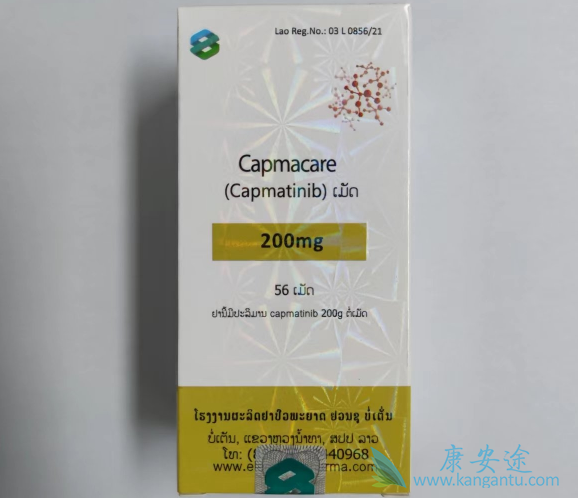
2022年8月10日,FDA公布授予了卡马替尼/卡帕替尼的常规批准,用于治疗经FDA批准的测试检测具有导致间充质-上皮转化(MET)外显子14跳跃的突变的成人转移性非小细胞肺癌(NSCLC)。此前于2020年5月获得FDA的加速批准。
先前该适应症的加速批准是基于2期GEOMETRY mono-1研究(NCT02414139)中的初始总体应答率(ORR)和应答持续时间(DOR)。先前接受治疗的患者和未接受治疗的患者的ORR分别为41%和68%。先前治疗的患者(28名反应者)的中位DOR为9.7个月,未治疗的患者(19名反应者)的中位DOR为12.6个月。在试验期间观察到的患者中最常见的副作用是恶心,呕吐,疲劳,呼吸短促,食欲下降和外周水肿。
转换为常规批准是基于另外63例确认MET外显子14跳跃的转移性非小细胞肺癌成人患者随访22个月的数据。患者每日两次口服卡马替尼/卡帕替尼 400mg,直至疾病进展或出现不可接受的毒性。
结果表明,在60名未经治疗的患者中,ORR为68%(95%CI,55-80),其中5%的患者达到完全缓解(CR),63%的患者达到部分缓解(PR)。中位应答持续时间(DOR)为16.6个月(95%CI,8.4-22.1);49%的患者出现持续至少12个月的DOR。
在100名先前接受过治疗的患者中,ORR为44%(95%CI,34-54);44%的患者有部分应答。中位DOR为9.7个月(95%CI,5.6-13);36%的患者的DOR持续至少12个月。
卡马替尼/卡帕替尼最常见的不良反应是水肿、恶心、肌肉骨骼疼痛、疲劳、呕吐、呼吸困难、咳嗽和食欲下降。更多信息可添加下方康安顾问微信咨询: