2017年8月31日,诺华(Novartis)宣布,美国FDA已经批准其CAR-T疗法Tisagenlecleucel(曾用名CTL019)上市,用于治疗B细胞前体急性淋巴性白血病(ALL),且病情难治,或出现两次及以上复发的25岁以下患者,商品名为Kymriah。FDA同时宣布扩大罗氏IL-6R抗体Actemra(托西珠单抗)的批准,用于治疗CAR-T疗法引起的CRS副反应。诺华同时获得一张优先审评券,因为Kymriah的获批,诺华又收获了FDA的一张儿科优先审评券。这也是FDA发出的第15张优先审评券,对诺华来说,算是一个小小的意外之喜。
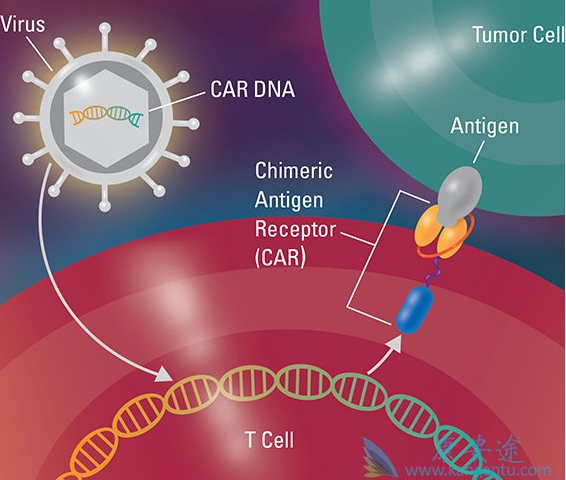
诺华的CAR-T疗法称为Kymriah定价为47.5万美元,接近此前分析师预测价格范围的下限:40-75万美元。诺华称第一个月内将在20个中心提供Kymriah,随后将增加到35个中心。诺华同时提到,正在与美国医疗保险与医疗补助服务中心(CMS)讨论“按疗效付费”的定价方案,如果确定该方案,只需对治疗有效的患者收费,在治疗后的一个月后付费。考虑到年轻患者巨大的“生命价值”,该方案的价格将明显高于47.5万美元,
CAR-T领域的三巨头(Juno、Kite、诺华)之争,诺华实现反超,疗效逆天的CAR-T也有其凶险之处,管控好副作用也是重中之重。Kymriah临床应用中确立了IL-6R单抗治疗CAR-T引起CRS的经典方案,对于CAR-T领域的贡献至关重要。期待Emily Whitehead的奇迹,随着Kymriah的上市更多的发生,期待整个CAR-T疗法领域继续前行。
详情请访问 CAR-T https://cart.kangantu.com













请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)