今年5月,FDA可能会批准Kymriah新的适应症,允许适用于非霍奇金淋巴瘤患者,这类疾病患者在美国每年大约新增30,000名,虽然大约三分之二的患者可以通过标准疗法得到治疗,但有将近一万人可以适用Kymriah,这无疑将大大拓宽后者的市场前景。回溯到2016年,CAR-T疗法Kymriah虽然尚未获批,但其已经显示出了良好的临床应用前景,因此诺华当时就在考虑其未来营销模式。诺华细胞和基因治疗部门负责人Usman Azam当时表示,如果CAR-T拿到FDA批文,诺华计划采用类似医疗器械的市场销售策略来推广该产品。在这种模式下,销售代表的功能类似于一个为医师提供技术支持的角色,主要负责提供理论培训和操作培训。
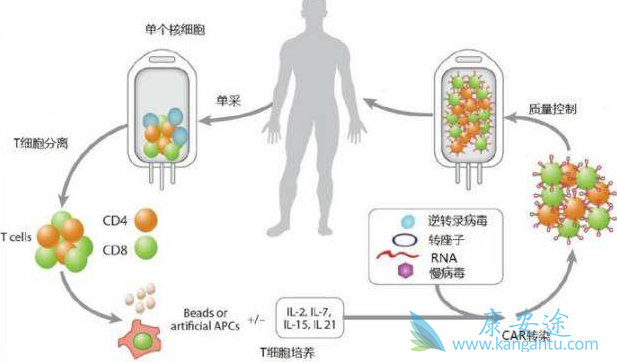
今年3月,南京传奇生物的CAR-T疗法获得了原国家食药监总局(CFDA)的临床试验批件,成为中国首个获批的临床的CAR-T疗法,有数据统计,中国的CAR-T研发和投资十分火爆,已经登记的临床研究为158个,只比美国少7个,在机构改革前,CFDA受理了约14个CAR-T临床申请。但是,作为风险和收益都极大的新兴疗法,疗效前景未必等同于市场表现。Kymriah一季度的市场表现也应该给中国的CAR-T疗法从业者提个醒。










请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)