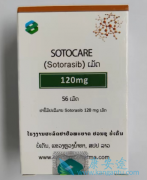
CodeBreaK 200全球第三阶段试验的详细结果显示,与静脉化疗多西他赛相比,KRAS G12C突变型非小细胞肺癌(NSCLC)患者每天口服一次索托拉西布Lumakras/Lumykras可显著提高无进展生存率(PFS;主要终点)和客观有效率(ORR;关键次要终点)。
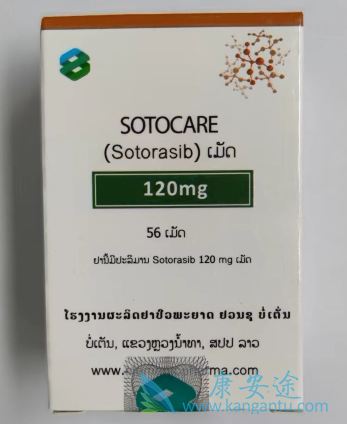
本研究的全部证据支持Lumakras/Lumykras作为携带KRAS G12C突变的非小细胞肺癌患者的重要靶向治疗选择,并增强了对所有晚期疾病患者进行全面生物标记物检测的迫切需要。根据盲法独立中央审查(BICR)确定,与多西他赛相比,重度预治疗患者中的Lumakras/Lumykras显著改善了PFS(HR,0.66[95%CI:0.51,0.86];P=0.002),并且在所有临床相关亚组中,PFS都支持Lumakras/Lumykras。Lumakras/Lumykras患者一年时PFS患者的比例为25%,而多西他赛患者为10%。Lumakras/Lumykras组的ORR明显高于多西他赛组,Lumakras/Lumykras有效率是其两倍(分别为28%和13%;P<0.001),并在其他疗效次要终点中表现出一致的益处,包括改善疾病控制率(DCR分别为83%和60%)。治疗组之间的总生存率(OS;关键次要终点)无显著差异。该研究没有检测OS的统计差异,在疾病进展后允许从多西紫杉醇到Lumakras/Lumykras的交叉。
与多西他赛相比,Lumakras/Lumykras治疗相关不良事件(TRAE)较少。等级≥3TRAE(33% Lumakras/Lumykras;40%多西他赛)和严重的TRAE(11% Lumakras/Lumykras;23%多西他赛)比多西他赛低。治疗组中至少15%的患者报告的最常见的TRAE是腹泻(34%的LUMKRAS;19%多西他赛),疲劳(7% Lumakras/Lumykras;25%多西他赛),脱发(1% LUMKARAS;21%多西他赛),恶心(14% Lumakras/Lumykras;20%多西他赛)和贫血(3% Lumakras/Lumykras;18%多西他赛)。“这是KRAS G12C抑制剂的第一个第3阶段随机临床试验,以显示其在治疗方案有限的重度预治疗患者中的益处,”田纳西州肿瘤学萨拉·坎农研究所肺癌研究主任、现任作者Melissa L.Johnson医学博士说,“令人鼓舞的是,所有临床相关亚组的无进展生存益处是一致的,Lumakras/Lumykras有效率是多西他赛的两倍多。这一数据代表了KRAS G12C突变非小细胞肺癌患者治疗的重大进步。”
CodeBreaK 200中的数据将提交给Lumakras/Lumykras加速批准或有条件营销授权的全球监管机构。Lumakras/Lumykras是世界上唯一在44个市场获得批准的KRASG12C抑制剂,包括美国、欧盟、英国和日本。CodeBreaK 200是首个针对KRASG12C抑制剂的随机对照临床试验。详情请扫码咨询: