患者按 1:1 随机分配接受卡博替尼或舒尼替尼(Sunitinib)治疗。使用动态分配方法按 IMDC 风险组(中等或差)和存在骨转移(是或否)对随机化进行分层。使用基于网络的国家癌症研究所肿瘤患者登记网络 (OPEN) 系统在登记时进行随机化。患者和研究人员对治疗不设盲。中央 IRC 对治疗分配不知情。在触发主要终点分析之前,不进行总体疗效分析,但对 PFS 进行的单一计划无效分析除外。
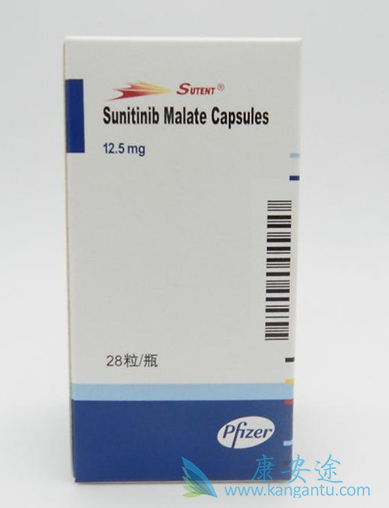
患者被随机分配接受卡博替尼60mg 每天一次或舒尼替尼 50mg 每天一次,持续 4 周,然后休息 2 周。卡博替尼由 Exelixis, Inc. (South San Francisco, CA, USA) 提供,舒尼替尼是商业购买的。可以通过剂量保持或减少来修改剂量以管理不良事件。卡博替尼的剂量减少至 40 毫克和 20 毫克,舒尼替尼的剂量减少至 37.5 和 25 毫克。患者继续治疗直到研究者评估的放射学疾病进展、对治疗不耐受或撤回同意。方案未规定治疗组之间的交叉。一个治疗周期定义为6周。每个周期都对安全性进行评估,包括不良事件、体格检查和标准实验室测试。
研究人员根据美国国家癌症研究所不良事件通用术语标准(4.0 版)报告治疗中出现的不良事件并进行分级。每次就诊时都会询问一些不良事件(丙氨酸氨基转移酶升高、天冬氨酸氨基转移酶升高、血胆红素升高、心电图 QT 延长、疲劳、高血压、中性粒细胞计数减少、掌跖红肿综合征、血小板计数减少、腹泻和胰腺炎)。对于征求的不良事件,报告了等级和与治疗的关系。对于不请自来的不良事件,仅当研究者认为它们与治疗相关时才需要报告1级或2级事件。
在基线和之后每 12 周进行一次磁共振成像或计算机断层扫描,直到进展或随机化后 5 年。由盲法中央独立审查委员会从这些地点收集射线照相图像以进行回顾性评估。研究人员和 IRC 使用实体瘤反应评估标准(RECIST 1.1 版)评估了肿瘤反应和进展。部分和完全响应需要在初始响应后 ≥4 周确认。在停止研究治疗后每 6 个月确定一次生存状态。
根据已发表的程序,通过免疫组织化学分析存档肿瘤组织以确定 MET 表达水平。福尔马林固定的石蜡包埋的肿瘤块由 Dana-Farber 癌症研究所的肿瘤病理学部门使用 SP44 抗体(Ventana Medical Systems, Inc, Tucson, AZ, USA)进行分析,MET 状态根据阳性或阴性分类≥50% 的肿瘤细胞被染色为 2 + 或 3 + 为阳性状态。更多舒尼替尼详情可咨询下方微信。













请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)