索马鲁肽(Semagalutide)试验一项单中心、随机、双盲、安慰剂对照、两期交叉试验。该试验是按照国际协调会议良好临床实践指南和赫尔辛基宣言进行的。符合条件的受试者年龄≥18岁,体重指数 (BMI) 为30至45kg/m2,HbA1c < 6.5% 且体重稳定(筛查前 3 个月内体重变化 < 3 kg)。关键排除标准是: 1 型或 2 型糖尿病的诊断;慢性/特发性急性胰腺炎病史;甲状腺髓样癌或 2 型多发性内分泌瘤综合征的个人/家族史;以前的肥胖手术治疗;吸烟或使用任何尼古丁产品;使用任何可能干扰试验结果的药物;或在试验期间预期生活方式的改变(例如,饮食、锻炼或睡眠方式)。在任何与试验相关的活动开始之前,所有参与者都获得了书面知情同意书。
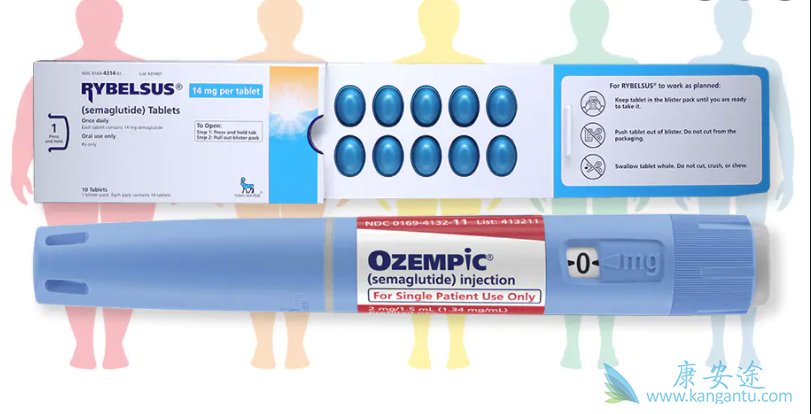
该试验包括两个 12 周的交叉治疗期,间隔为 5 至 7 周的清除期。符合条件的受试者以1:1的比例随机分配到两种治疗序列之一:索马鲁肽-安慰剂或安慰剂-索马鲁肽。受试者每周一次皮下 (sc) 接受索马鲁肽(1.34 mg/mL) 或匹配的安慰剂。起始剂量为 0.25 毫克(4 周),逐渐增加到 0.5 毫克(4 周),然后是 1.0 毫克(4 周)。受试者在每个治疗期的最后一次就诊时接受了第五剂(在诊所给药)1.0mg,并进行了评估。每次剂量增加时,受试者都到诊所就诊,并通过短信或电话提醒受试者在家中给药剩余剂量。
主要终点是治疗12周后午餐期间(标准化早餐后 5 小时)随意摄入能量。次要终点包括:在随后的晚餐和晚餐盒中随意摄入能量;直到午夜的白天随意摄入的总能量;随意午餐时间;标准化早餐前后食欲参数、口渴、恶心和幸福感的评分;随意的适口性膳食;能量消耗(静息代谢率 [RMR] 和呼吸商 [RQ]);控制过去一周的饮食和对食物的渴望;食物偏好;体重;和身体成分(脂肪和无脂肪质量)。此外,还研究了索马鲁肽的多剂量药代动力学 (PK) 以及安全性和耐受性。
在每个12周的治疗期结束时,受试者参加一次内部住宿。在他们逗留的第1天,受试者在膳食、身体活动和睡眠方面进行了标准化。最后一剂试验药物在晚上给药。第 2 天,进行了 5 小时的标准化早餐餐测试(大量营养素组成:大约 30 能量百分比 [E%] 脂肪、15 E% 蛋白质、55 E% 碳水化合物);餐点在〜 上午 8:00供应。在该测试之后,过量供应均质的随意午餐并记录用餐时间。
在~6:00pm ,受试者被给予自助晚餐。对于午餐和晚餐,受试者都被要求吃到令人愉悦的饱腹感;测量食物消耗量。在7:00 pm, 受试者收到由四种食物类别组成的晚间零食盒(四种食物,每种 100 克:高脂肪和甜味;低脂肪和甜味;高脂肪和非甜味;低脂肪和非甜味;个性化偏好),他们被允许保留到午夜。记录每个食品类别的消费量。更多索马鲁肽详情可咨询下方微信。















请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)